Este es un tema que os suele gustar bastante. Así que, a por él que encima es cortito.
REACCIONES DE OXIDACIÓN-REDUCCIÓN
La oxidación es el proceso mediante el cual una sustancia (agente reductor) pierde electrones.
La reducción es el proceso mediante el cual una sustancia (agente oxidante) gana electrones.
Una redox o reacción de oxidación-reducción es una reacción en la que un agente reductor se oxida al ceder electrones y un agente oxidante se reduce al aceptarlos.
Vamos a ver con un par de ejemplos cómo se ajustan este tipo de reacciones en medio ácido y en medio básico.
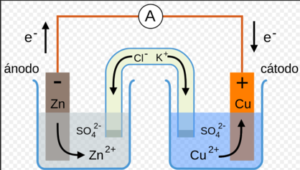
PILAS O CELDAS ELECTROQUÍMICAS: Una pila electroquímica es un dispositivo que permite obtener una corriente eléctrica a partir de una reacción redox espontánea. Consta de las siguientes partes:
- Ánodo, que es el electrodo donde se produce la oxidación (polo negativo).
- Cátodo, que es el electrodo donde se produce la reducción (polo positivo).
- Los electrodos están formados por una lámina de metal, introducida en una disolución de sal de ese metal.
- Los electrodos se conectan externamente mediante un hilo conductor que permite el paso de los electrones desde el ánodo al cátodo. Este circuito se cierra a través de un puente salino que conecta ambas disoluciones y evita la acumulación de cargas.
- Pila Daniell: La A es un aparato (voltímetro) que se conecta para medir el voltaje o fuerza de la pila
NOTACIÓN DE LA PILA: Se escribirá primero la oxidación, en el orden que se produce y separado por dos barras la reducción en el orden en el que ocurre también. Por ejemplo:
– Zn (s) / Zn+2 (ac 1M) // Cu+2 (ac 1M) / Cu (s) +
Oxidación (ánodo) Reducción (cátodo)
Podremos calcular también la fuerza electromotriz de la pila (fem) o el potencial de la pila restando el potencial estándar del cátodo menos el del ánodo: f.e.m. = pila = cátodo –
ánodo
Si pila es positiva (
0) entonces
0, tendremos una reacción espontánea y la pila funcionará en el sentido indicado de la ecuación. La especie con mayor potencial de reducción se reducirá en el cátodo, mientras que la especie con mayor potencial se oxidará en el ánodo (Recuerda! El más negativo es el que tiene más ganas de hacer la oxidación)
ELECTRÓLISIS: Es el proceso en el que el paso de la corriente eléctrica por una disolución o por un electrolito fundido produce una reacción de oxidación-reducción no espontánea.
Consta de una cuba electrolítica, que es el recipiente donde se realiza el proceso. En ella van sumergidos dos electrodos conectados a una fuente de corriente continua que suministra los electrones para que transcurra la reacción redox no espontánea.
Al igual que en la pila, en el ánodo se produce la oxidación, pero ahora es el polo positivo (conectado al polo positivo del generador) y atrae los iones cargados negativamente. En el cátodo se produce la reducción, pero es el polo negativo (conectado al polo negativo del generador) y atrae los iones cargados positivamente.
LEY DE FARADAY: y Q = I
t
Donde Q es la carga que circula, medida en culombios (C)
I es la intensidad de corriente, medida en Amperios (A)
t es el tiempo en segundos
m es la masa del elemento desprendida en gramos
M es la masa molar del elemento en gramos
F : 1 Faraday = 96487C
Z es el número de electrones que intervienen.
Holi!!! Aquí te dejo una web para que puedas corregirte las reacciones (es como una calculadora de redox) https://www.periodni.com/es/metodo_de_semi-reacciones.php
En la pestaña de materiales te dejo unos ejercicios para practicar.